Pengertian dan Jenis-jenis Validasi
Pengertian Validasi
Istilah Validasi pertama kali dicetuskan oleh Dr. Bernard T. Loftus, Direktur Food and Drug Administration (FDA) Amerika Serikat pada akhir tahun 1970-an, sebagai bagian penting dari upaya untuk meningkatkan mutu produk industri farmasi. Hal ini dilatar belakangi adanya berbagai masalah mutu yang timbul pada saat itu yang mana masalah-masalah tersebut tidak terdeteksi dari pengujian rutin yang dilaksanakan oleh industri farmasi yang bersangkutan. Selanjutnya, Validasi juga diadopsi oleh negara-negara yang tergabung dalam Pharmaceutical Inspection Co-operation/Scheme (PIC/S), Uni Eropa (EU) danWorld Health Organization (WHO). Bahkan, Validasi merupakan aspek kritis (substantial aspect) dalam penilaian kualitas industri farmasi yang bersangkutan.
Validasi diartikan sebagai suatu tindakan pembuktian dengan cara yang sesuai bahwa tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi dan pengawasan akan senantiasa mencapai hasil yang diinginkan.
Dari definisi-definisi tersebut tersebut di atas membawa pengertian, bahwa :
- Validasi adalah suatu tindakan pembuktian, artinya validasi merupakan suatu pekerjaan “dokumentasi”.
- Tata cara atau metode pembuktian tersebut harus dengan “cara yang sesuai”, artinya proses pembuktian tersebut ada tata cara atau metodenya, sesuai dengan prosedur yang tercantum dalam CPOB.
- “Obyek” pembuktian adalah tiap-tiap bahan, proses, prosedur, kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi dan pengawasan mutu (ruang lingkup).
- Sasaran/target dari pelaksanaan validasi ini adalah bahwa seluruh obyek pengujian tersebut akan senantiasa mencapai hasil yang diinginkan secara terus menerus (konsisten).
Jenis-jenis Validasi
1. Kualifikasi Mesin, Peralatan dan Sarana Penunjang, terdiri dari :
- Design Qualification (DQ)/Kualifikasi Disain (KD)
- Installation Qualification (IQ)/Kualifikasi Instalasi (KI)
- Operational Qualification (OQ)/Kualifikasi Operasional (KO)
- Performance Qualification (PQ)/Kualifikasi Kinerja (KK)
2. Validasi Metode Analisa
3. Validasi Proses Produksi,
4. Validasi Proses Pengemasan
5. Validasi Pembersihan (Cleaning Validation)
Langkah-langkah Pelaksanaan Validasi
Begitu luasnya cakupan validasi, terkadang membingungkan kalangan praktisi di industri farmasi untuk melaksanakan validasi. FDA dalam “Guideline on General Principles of Process Validation”, memberikan panduan langkah-langkah dalam pelaksanaan validasi, yang tertuang dalam “validation life cycle” berikut ini, yaitu :
- Membentuk Validation Comitee (Komite Validasi), yang bertanggung jawab terhadap pelaksanaan validasi di industri farmasi yang bersangkutan.
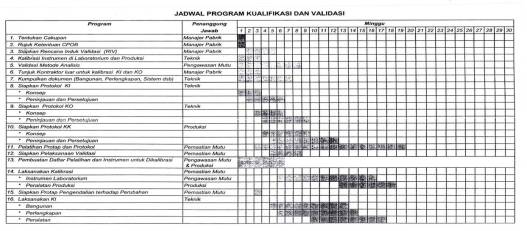
- Menyusun Validation Master Plan (Rencana Induk Validasi), yaitu dokumen yang menguraikan (secara garis besar) pedoman pelaksanaan validasi di industri farmasi yang bersangkutan.
- Membuat Dokumen Validasi, yaitu protap (prosedur tetap), protokol serta laporan validasi.
- Pelaksanaan validasi.
- Melaksanakan Peninjauan Periodik, Change Control dan Validasi ulang (revalidation).
Validation Master Plan (VMP) merupakan dokumen yang menyajikan informasi mengenai program kerja/kegiatan validasi pada industri farmasi yang bersangkutan secara keseluruhan, termasuk jadwal pelaksanaannya.
Dokumen RIV memuat antara lain :
- Kebijakan validasi.
- Struktur organisasi kegiatan validasi (komite validasi).
- Ringkasan fasilitas, sistem, peralatan, dan proses yang akan divalidasi.
- Format dokumen: format protokol dan laporan validasi, perencanaan dan jadwal pelaksanaan validasi.
- Pengendalian perubahan.
- Acuan dokumen yang digunakan.






















































No comments:
Post a Comment